Prerequisite
混合気体が化学反応 (chemical reaction) を起こす系を考えよう.
化学反応とは例えば
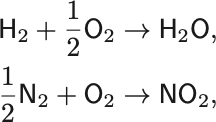
のようにかかれる.
化学反応式の矢印の向きの反応を正反応,逆向きを逆反応という.
十分時間が経つと正反応と逆反応がつり合った化学平衡状態 (chemical equilibrium state) に達する.
平衡状態での物質 による化学反応式を形式的に

と表記することにする.
各係数 は全て
以上の整数である.
いま化学反応は温度と圧力が環境によって制御されて一定のもとで進むとする.
温度と圧力が一定のもとでの平衡状態ではGibbsの自由エネルギーが最小である.
そこで化学平衡状態におけるGibbsの自由エネルギーが最小と仮定すると

が成り立たなければならない. は仮想的な化学反応によって微小変化した粒子数.
1次までで展開すれば
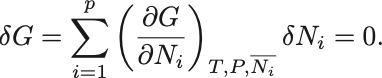
化学反応による粒子数の変化 は化学反応式によって拘束されている.
物質 が
だけ変化する場合,他の物質
は
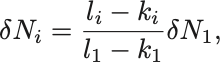
だけ変化している.
化学ポテンシャルが であることと併せて,化学平衡のための条件は
化学平衡のための条件
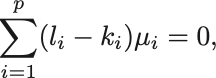
となる.
複数の化学反応が起こる場合は化学反応式の数だけ同様の条件が成立する(問題参照).
気体は全て理想気体とみなすと系のGibbsの自由エネルギーは
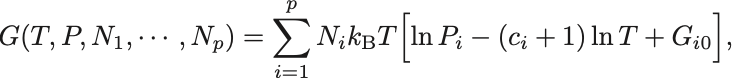
で与えられる.
化学ポテンシャルは
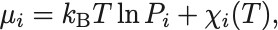
と書ける.
ここで は温度のみの函数.
化学平衡のための条件に代入すれば
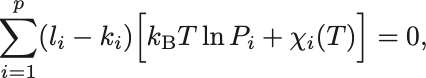
温度に依存する部分を右辺へまとめれば
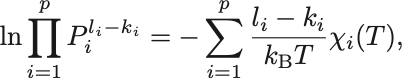
したがって,
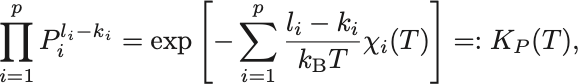
を得る.
温度のみの函数 は化学平衡定数,または単に平衡定数とよばれる.
つまり温度が一定の下での各物質の分圧の特定の比は一定値となることが示された.
これを質量作用の法則 (law of mass action) という.
分圧ではなく粒子数比 を用いると
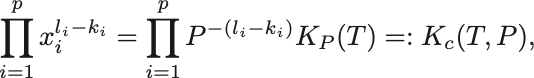
ともかける.
こちらの も温度と圧力が一定のもとで定数なので化学平衡定数と呼ばれる.
最後に希薄溶液中での溶質どうしの化学平衡状態を考えよう.
溶媒は反応に関与しないとする; .
溶質の化学ポテンシャルは
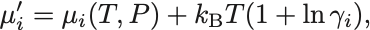
ここで は
番目の溶質単体のときの化学ポテンシャル.
化学平衡の条件へ代入すれば
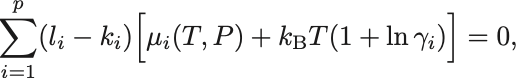
同様に温度と圧力に依存する部分を右辺へまとめれば,濃度に関する質量作用の法則,
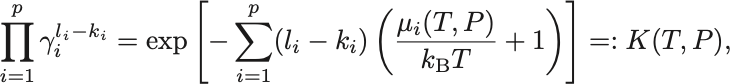
が成立する.
化学の分野では物質 の濃度を
と表記することがある.
この表記で質量作用の法則は
濃度についての質量作用の法則
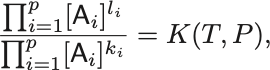
と書かれる.
化学反応の平衡については物質の拡散と反応の速度のバランスが重要である.
理想気体とみなせるような密度の低い状態では気体分子が十分接近するときにだけ化学反応が起こる.
したがってもし気体の拡散するスピードが遅い場合化学反応が局所的に進行してムラが生じる.
こうした気体分子の反応と拡散は一般に反応拡散方程式と呼ばれる非線型の微分方程式で記述される.
反応拡散方程式にはTuringパターンと呼ばれるような物質の規則的なムラを示す定常解が知られている.
実際,熱帯魚など表面に見られる縞模様はTuringパターンで説明できることが知られている.
化学反応式から反応拡散方程式を導く系統的手法については非平衡統計力学の章で論じる.
化学平衡状態の議論は化学反応以外にも応用可能である.
たとえば原子核物理における元素合成や素粒子の対生成・消滅やベータ崩壊・逆ベータ崩壊過程の平衡状態に適用できる.
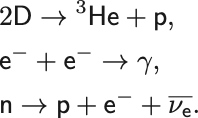
ここで は重水素(陽子1つと中性子1つからなる).
元素合成の平衡状態に関しては初期宇宙の元素の構成比の計算において重要である.
また非常に高密度の天体では陽子が電子を捕獲する反応が起こりやすくなり,中性子の多い平衡状態に遷移する.

これは中性子星として知られる.
これらの平衡には量子効果が関係してくるため量子統計力学の章で議論する.
マクロな現象に応用した例では,生物物理学における肉食動物と草食動物の個体数変動を記述するLotka–Volterraモデルや単細胞生物の分裂と死を記述するFisher–Kolmogorovモデルなどが知られている.
後者については(免疫を無視した)感染症の伝染モデルとしても重要である.
また近年実験的にも重要なモデルは界面の成長を記述するKardar–Parisi–Zhangモデルがある.
これは溶液中で核から析出する結晶の表面や,紙を燃え広がる火炎面など非常にたくさんの現象を記述する.
これらのモデルについては粗視化Lengevin方程式の章で議論する.
Problems
種類からなる多成分系において
種類の化学反応が起こる場合に,温度と圧力一定のもとでの化学平衡の条件を導け.
種類の化学反応式を
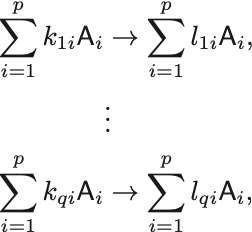
と書く.
仮想的に粒子数が だけ微小変化したとするとGibbsの自由エネルギーが最小の条件から
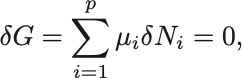
が導かれる. は化学反応によって拘束されている.
まず
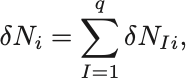
と各化学反応式ごとの変化分に分解する.
すると化学反応式の係数を用いて
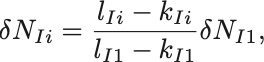
と書ける.
これらを代入すれば
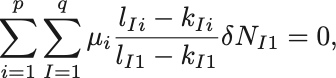
反応式ごとの粒子数の変化は独立なので各 で独立に
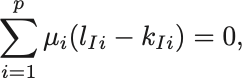
が求める条件である.
